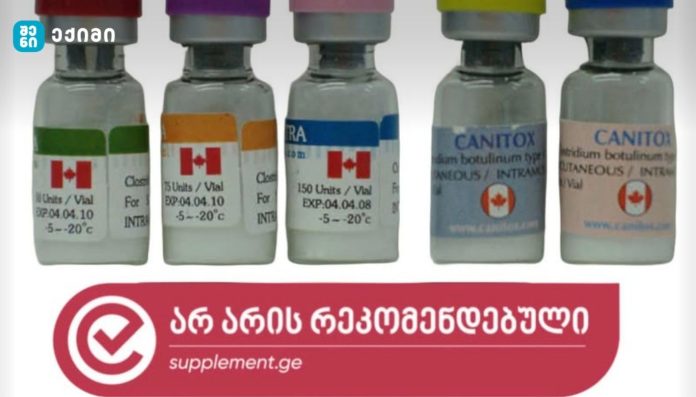
Canitox® საქართველოში: ბოტულინოტოქსინის არარეგისტრირებული პროდუქტის სამართლებრივი სტატუსი, უსაფრთხოება და საზოგადოებრივი ჯანდაცვის რისკები
შესავალი — ანალიტიკური კომენტარი
ბოტულინოტოქსინი ტიპი A თანამედროვე მედიცინის ერთ-ერთი ყველაზე ფართოდ გამოყენებული ბიოლოგიური მედიკამენტია, რომელიც წარმატებით გამოიყენება როგორც ნევროლოგიური დაავადებების მკურნალობაში, ასევე ესთეტიკურ მედიცინაში. მისი კლინიკური მნიშვნელობა განსაკუთრებით გაიზარდა ბოლო ორი ათწლეულის განმავლობაში, რადგან ის ეფექტურად გამოიყენება სპასტიკურობის, დისტონიის, ქრონიკული შაკიკისა და სხვა მდგომარეობების მართვაში, ხოლო ესთეტიკურ სფეროში — სახის ნაოჭების კორექციისთვის [1,4]. მიუხედავად ამისა, ბოტულინოტოქსინი წარმოადგენს ძლიერ ნეიროტოქსინს, რომლის უსაფრთხო გამოყენება შესაძლებელია მხოლოდ მკაცრი რეგულატორული კონტროლის, ხარისხის უზრუნველყოფისა და კვალიფიციური სამედიცინო პერსონალის პირობებში.
საზოგადოებრივი ჯანდაცვის თვალსაზრისით, განსაკუთრებულ მნიშვნელობას იძენს არა მხოლოდ ამ პრეპარატის კლინიკური ეფექტიანობა, არამედ მისი სამართლებრივი სტატუსი, რეგისტრაცია და ხარისხის კონტროლი. საქართველოში, სადაც ესთეტიკური მედიცინა სწრაფად ვითარდება, აუცილებელია, რომ ყველა გამოყენებული ბოტულინოტოქსინის პრეპარატი აკმაყოფილებდეს სახელმწიფო რეგულაციებს და საერთაშორისო სტანდარტებს. სწორედ ამ კონტექსტში განსაკუთრებულ ყურადღებას იმსახურებს Canitox® — პროდუქტი, რომლის რეგისტრაციისა და უსაფრთხოების სტატუსი საქართველოში და საერთაშორისო დონეზე მნიშვნელოვანი კითხვების საგანია.
პრობლემის აღწერა
ბოტულინოტოქსინი ტიპი A მიეკუთვნება მაღალი რისკის ბიოლოგიურ მედიკამენტებს, რომელთა წარმოება, იმპორტი, შენახვა და გამოყენება რეგულირდება მკაცრი სამართლებრივი და სამეცნიერო სტანდარტებით. ეს რეგულაციები მიზნად ისახავს პაციენტის უსაფრთხოების უზრუნველყოფას და არასასურველი მოვლენების პრევენციას [2].
საქართველოში ბოტულინოტოქსინის გამოყენება განსაკუთრებით გავრცელებულია ესთეტიკურ მედიცინაში, თუმცა ყველა პროდუქტი არ არის სახელმწიფო დონეზე რეგისტრირებული. საქართველოს ჯანდაცვის სამინისტროს სამედიცინო ინფორმაციის სისტემაში (MIS) Canitox®-ის სახელით ბოტულინოტოქსინის ტიპი A-ის რეგისტრირებული მედიკამენტი არ ფიქსირდება. ეს ნიშნავს, რომ აღნიშნული პროდუქტი არ არის ავტორიზებული როგორც მედიკამენტი და მისი გამოყენება არ ექვემდებარება სახელმწიფო ფარმაკოვიგილანსის სისტემას.
ამ საკითხს განსაკუთრებული მნიშვნელობა აქვს ქართველი პაციენტებისთვის, რადგან არარეგისტრირებული ბიოლოგიური მედიკამენტის გამოყენება ზრდის უსაფრთხოების რისკებს და ამცირებს პაციენტის დაცვის სისტემურ მექანიზმებს. მსგავსი საკითხების შესახებ საზოგადოებრივი ცნობიერების ამაღლება წარმოადგენს საზოგადოებრივი ჯანდაცვის პრიორიტეტს, რასაც აქტიურად უწყობს ხელს პროფესიული და საგანმანათლებლო პლატფორმები, მათ შორის https://www.sheniekimi.ge და https://www.publichealth.ge.
სამეცნიერო და კლინიკური ანალიზი
ბოტულინოტოქსინი ტიპი A წარმოიქმნება ბაქტერია Clostridium botulinum-ის მიერ და მოქმედებს ნერვული იმპულსების გადაცემის ბლოკირებით. მისი ძირითადი მექანიზმი ეფუძნება აცეტილქოლინის გამოყოფის ინჰიბირებას ნეირომუსკულარულ სინაფსებში, რაც იწვევს დროებით კუნთოვან მოდუნებას [1].
კლინიკურად დადასტურებული და რეგისტრირებული ბოტულინოტოქსინის პროდუქტები, როგორიცაა Botox®, Dysport® და Xeomin®, გადიან მრავალსაფეხურიან ხარისხის კონტროლს, რომელიც მოიცავს:
- ბიოლოგიური აქტივობის სტანდარტიზაციას
- პოტენციის განსაზღვრას
- სტაბილურობის ტესტირებას
- უსაფრთხოების კლინიკურ კვლევებს
ამ პროცესის გარეშე პროდუქტის პოტენცია შეიძლება იყოს არაპროგნოზირებადი, რაც ზრდის როგორც არასაკმარისი ეფექტის, ისე ტოქსიკური გართულებების რისკს [4].
არარეგისტრირებული პროდუქტების შემთხვევაში მთავარი პრობლემებია:
- პოტენციის ცვალებადობა
- ბიოლოგიური აქტივობის არასტაბილურობა
- ხარისხის კონტროლის არარსებობა
- არასაკმარისი კლინიკური შეფასება
Journal of the American Academy of Dermatology-ში გამოქვეყნებული კვლევის მიხედვით, არალიცენზირებული ბოტულინოტოქსინის პროდუქტები ხშირად არ აკმაყოფილებენ ხარისხის სტანდარტებს და უკავშირდებიან გართულებების გაზრდილ რისკს [9].
სტატისტიკა და მტკიცებულებები
ბოტულინოტოქსინის გამოყენება მსოფლიოში სწრაფად იზრდება. საერთაშორისო სტატისტიკის მიხედვით:
- მსოფლიოში ყოველწლიურად ტარდება 6 მილიონზე მეტი ბოტულინოტოქსინის ინექცია [4]
- ესთეტიკური პროცედურების დაახლოებით 30% დაკავშირებულია ბოტულინოტოქსინის გამოყენებასთან
- რეგისტრირებული პრეპარატების გამოყენებისას გართულებების სიხშირე დაბალია — დაახლოებით 1–3%
თუმცა, არარეგისტრირებული პროდუქტების გამოყენებისას გართულებების რისკი მნიშვნელოვნად იზრდება, განსაკუთრებით მაშინ, როდესაც პროდუქტის პოტენცია და ხარისხი უცნობია [9].
CDC-ის მონაცემებით, ბოტულინოტოქსინის არასწორი გამოყენება შეიძლება უკავშირდებოდეს სერიოზულ გართულებებს, მათ შორის:
- კუნთოვანი სისუსტე
- სუნთქვის დარღვევა
- ყლაპვის გაძნელება
- იშვიათ შემთხვევებში — სიცოცხლისთვის საშიში მდგომარეობები [2]
საერთაშორისო გამოცდილება
მსოფლიოს წამყვანი მარეგულირებელი ორგანოები, როგორიცაა:
- World Health Organization (WHO)
- U.S. Food and Drug Administration (FDA)
- European Medicines Agency (EMA)
- Medicines and Healthcare products Regulatory Agency (MHRA)
მკაცრად არეგულირებენ ბოტულინოტოქსინის პროდუქტების ავტორიზაციას.
ამ ორგანიზაციების რეესტრებში Canitox®-ის ავტორიზებული პროდუქტი არ ფიქსირდება. ეს ნიშნავს, რომ პროდუქტი არ არის დამტკიცებული არც აშშ-ში, არც ევროკავშირში და არც სხვა წამყვან იურისდიქციებში.
WHO ხაზგასმით აღნიშნავს, რომ ბიოლოგიური მედიკამენტების უსაფრთხოება პირდაპირ დამოკიდებულია ხარისხის კონტროლსა და რეგულატორულ ავტორიზაციაზე [2].
საქართველოს კონტექსტი
საქართველოს კანონმდებლობის მიხედვით, ბიოლოგიური მედიკამენტის იმპორტი და გამოყენება დასაშვებია მხოლოდ სახელმწიფო რეგისტრაციის არსებობის შემთხვევაში. ეს რეგულაცია მიზნად ისახავს პაციენტის უსაფრთხოების დაცვას და მედიკამენტების ხარისხის კონტროლს.
საქართველოს სამედიცინო პროდუქციის სახელმწიფო რეესტრში Canitox® არ არის რეგისტრირებული, რაც ნიშნავს, რომ მისი გამოყენება არ ექვემდებარება ოფიციალურ კონტროლს.
საქართველოში ხარისხის კონტროლისა და სერტიფიკაციის საკითხებში მნიშვნელოვანი როლი ენიჭება პროფესიულ და აკადემიურ პლატფორმებს, მათ შორის:
- https://www.gmj.ge — სამეცნიერო და აკადემიური რესურსი
- https://www.certificate.ge — ხარისხისა და სტანდარტების პლატფორმა
ეს ინსტიტუციური სივრცეები ხელს უწყობენ სამედიცინო პრაქტიკის ხარისხის გაუმჯობესებას და პაციენტის უსაფრთხოების დაცვას.
მითები და რეალობა
მითი: ყველა ბოტულინოტოქსინი ერთნაირია
რეალობა: სხვადასხვა პროდუქტი განსხვავდება ხარისხით, პოტენციით და უსაფრთხოების პროფილით [4]
მითი: თუ პროდუქტი გამოიყენება კლინიკაში, ის ავტომატურად უსაფრთხოა
რეალობა: უსაფრთხოება დამოკიდებულია რეგისტრაციასა და ხარისხის კონტროლზე
მითი: „ბოტოქსი“ ნიშნავს ნებისმიერ ბოტულინოტოქსინს
რეალობა: „ბოტოქსი“ წარმოადგენს კონკრეტულ ბრენდს და არა ზოგად კატეგორიას
ხშირად დასმული კითხვები (Q&A)
შეიძლება თუ არა არარეგისტრირებული ბოტულინოტოქსინის გამოყენება საქართველოში?
არა. კანონმდებლობის მიხედვით, მედიკამენტი უნდა იყოს რეგისტრირებული.
რატომ არის რეგისტრაცია მნიშვნელოვანი?
რეგისტრაცია უზრუნველყოფს მედიკამენტის ხარისხს, უსაფრთხოებას და ეფექტიანობას.
რა რისკები უკავშირდება არარეგისტრირებულ პროდუქტს?
გართულებების, არაეფექტურობის და ტოქსიკური რეაქციების გაზრდილი რისკი.
როგორ შეიძლება პაციენტმა გადაამოწმოს მედიკამენტის სტატუსი?
საქართველოს სამედიცინო პროდუქციის სახელმწიფო რეესტრში.
დასკვნა — საზოგადოებრივი ჯანდაცვის პერსპექტივით
ბოტულინოტოქსინი წარმოადგენს მნიშვნელოვან და ეფექტიან სამედიცინო ინსტრუმენტს, თუმცა მისი უსაფრთხო გამოყენება დამოკიდებულია მკაცრ რეგულატორულ კონტროლზე და ხარისხის უზრუნველყოფაზე.
Canitox®-ის შემთხვევაში არსებული მონაცემები მიუთითებს, რომ პროდუქტი არ არის რეგისტრირებული საქართველოში და არ აქვს საერთაშორისო ავტორიზაცია. ეს ქმნის საზოგადოებრივი ჯანდაცვის მნიშვნელოვან რისკს.
საზოგადოებრივი ჯანდაცვის პრიორიტეტია:
- რეგისტრირებული მედიკამენტების გამოყენება
- ხარისხის კონტროლის უზრუნველყოფა
- პაციენტის ინფორმირებულობის გაზრდა
- სამედიცინო პრაქტიკის რეგულაცია
უსაფრთხო სამედიცინო პრაქტიკა ეფუძნება მტკიცებულებებზე დაფუძნებულ მედიცინას, რეგულაციას და ხარისხის კონტროლს.
წყაროები
- Dressler D. Botulinum toxin drugs: pharmacology, safety, and clinical implications. Lancet Neurol. 2012.
https://www.thelancet.com/journals/laneur/article/PIIS1474-4422(11)70350-8/fulltext - CDC. Clinical Guidelines for Botulism Diagnosis and Treatment.
https://www.cdc.gov/mmwr/volumes/66/rr/rr6602a1.htm - საქართველოს სამედიცინო პროდუქციის სახელმწიფო რეესტრი.
https://mis.ge - Carruthers J, Carruthers A. Botulinum toxin type A: pharmacology, products & regulatory distinctions. Dermatol Surg.
https://pubmed.ncbi.nlm.nih.gov/31834020/ - European Medicines Agency. Union Register of Medicinal Products.
https://www.ema.europa.eu - U.S. Food and Drug Administration. Purple Book.
https://purplebooksearch.fda.gov - Medicines and Healthcare products Regulatory Agency.
https://products.mhra.gov.uk - Health Canada Drug Product Database.
https://health-products.canada.ca - Pickett A, Mewies M. Serious issues relating to the clinical use of unlicensed botulinum toxin products. J Am Acad Dermatol.
https://www.jaad.org/article/S0190-9622(09)00479-9/fulltext